FACULTAD DE QUIMICOFARMACOBIOLOGIA.
LABORATORIO DE ANALISIS DE ALIMENTOS.
PROFESOR TITULAR.
IBQ. RODRIGO MERLOS DIAZ.
LABORATORISTA.
QBF.RAFAEL ZAMORA VEGA.
PRACTICA No. 3.
ANALISIS DE LECHE PASTEURIZADA Y ULTRAPASTEURIZADA.
INTEGRANTES.
ALVAREZ ESQUIVEL FANY ELISA
BOIZO CORREA LUZ MARIA.
SERRANO ORTEGA JOEL
MORELIA MICHOACAN, NOVIEMBRE DEL 2008.
ANÁLISIS DE LECHE PASTEURIZADA Y ULTRAPASTEURIZADA
FUNDAMENTO:
La pasteurización es la operación a la que se someten determinados productos alimenticios para destruir por acción del calor los microorganismos patógenos y la mayoría de los gérmenes restantes, con fines higiénicos o de conservación, preservando al máximo las características físicas, bioquímicas y organolépticas del producto.
La pasteurización, que permite la conservación durante un tiempo determinado, se basa en las leyes de destrucción térmica de los microorganismos. Dichas leyes toman en consideración esencialmente el número de microorganismos presentes, la temperatura a la que tiene lugar el proceso y el tiempo durante el que se mantiene dicha temperatura. La pasteurización se efectúa generalmente a temperaturas inferiores a los 100 ºC y debe ser seguida de un enfriamiento rápido. Siempre resulta interesante operar a una temperatura más alta durante un tiempo más breve con el fin de, obteniendo idénticos resultados bacteriológicos, conservar en mayor grado las cualidades originales del producto. La pasteurización se puede efectuar una vez envasado el producto o previamente a esta operación.
Después de la pasteurización la leche debe conservarse a una temperatura no superior a los 4 ºC debido a que el método de la pasteurización solo destruye las formas vegetativas y no las esporuladas. Esta también es la razón por la cual la leche pasteurizada se debe consumir en un periodo de tiempo no superior al mes, al contrario que la leche uperisada o U.H.T. que ha sido esterilizada en su totalidad, destruyendo formas vegetativas y esporuladas, por lo que dura más tiempo.
· Leche pasteurizada
La leche es sometida a temperaturas entre los 72° y 75°C, durante 15 a 20 segundos, eliminando los microorganismos que dañan la salud del ser humano, sin embargo, quedan presentes algunos microorganismos, lo cual obliga a refrigerar la leche aunque se encuentre en envase cerrado.
La pasteurización, o pasterización comprende los siguientes pasos:
* Filtración y centrifugación suave de la leche cruda para separar sólidos en suspensión.
* Calentamiento para provocar la muertede los microorganismos, sean inocuos o patógenos.
En la pasteurización lenta o pasterización baja la leche que circula dentro de cañerías, se calienta a 65°C durante 30 minutos.
En la pasteurización rápida o pasterización alta la leche se desliza sobre láminas metálicas formando capas muy delgadas de 1 milímetro de espesor. Se la calienta a mayor temperatura: 80°C, pero durante menos tiempo, aproximadamente 30 segundos.
La pasteurización rápida se ha impuesto por su mayor eficiencia: elimina el 99,5% de los gérmenes y además no modifica sensiblemente las características naturales, en particular, el gusto.
Aunque la pasteurización elimina todo riesgo posible, resulta fundamental enfatizar sobre la importancia de los rodeos sanos en la producció de alimentos desde su origen.
· Leche Ultrapasteurizada (U.H.T. Ultra High Temperature)
Esta leche se obtiene calentando la leche hasta temperaturas entre 135°C y 140°C durante unos cuantos segundos y luego enfriándola rápidamente en un sistema pasteurizado. Posteriormente se envasa la leche en ambiente y un envase asépticos (esterilizados). Esta leche tiene hasta 180 días de vida estando en envase cerrado, y para ello no requiere de ningún tipo de conservador.
Tanto la leche pasteurizada como la ultrapasteurizada poseen el mismo valor nutritivo, la diferencia está en que la U.H.T. Alarga la vida de la leche hasta por 180 días, mientras que la pasteurizada tiene una duración escasa de tan sólo 5 a siete días en refrigeración.
Pasteurizador: los pasteurizadores utilizados para pasteurizar la leche, son intercambiadores de calor, de placas o tubos, que utilizan como manantial de calor agua caliente, vapor o, en algunos casos, radiaciones infrarrojas. Son de acero inoxidable y constan de varias secciones: sección de intercambio de calor entre la leche fría que entra y la leche caliente que sale; sección de calentamiento, donde la leche alcanza la temperatura deseada; sección de mantenimiento, donde esta temperatura se mantiene durante el tiempo deseado; y sección de enfriamiento final de la leche, primero mediante intercambio de calor con agua fría y luego con agua helada.
OBSERVACIONES.
- Al realizar la tecnica para saber cuanta cantidad de grasa contenia la leche ultrapasteurizada no se obtuvo, ya que la que usamos para el analisis era una leche ligth.
- No encontramos nada extraño al analizar la leche.
Análisis organoléptico.
1. Olor.
2. Color.
3. Sabor.
Análisis Fisicoquímico.
Acidez.
1. Pesar 9g.
2. Diluir con 10 ml H2O destilada.
3. Adicionar 5 gotas de fenolftaleína.
4. Titular con NaOH 0.1 N.
5. Visualizar coloración rosa pálido.
% acidez= V x N x 0.090/ M (100%)
1. Pesar 100 g de leche.
2. Transferir a matraz EM 250 ml
3. Calibrar potenciómetro con sol. Buffer pH 7
4. Introducir electrodo a la leche
5. Registrar temperatura.
Sólidos Totales.
1. Poner la capsula de porcelana a peso constante.
2. Pesar 0.1 mg (10 g de leche).
3. Mezclar y calentar a BM 20 min.
4. Secar en estufa 4 hrs a 99°C.
5. Retirar capsula de la estufa y transferir a desecador.
6. Pesar hasta peso constante.
% sólidos totales = (b + a)/ P x 100
Sólidos no grasos.
1. Se determina por la siguiente diferencia.
Sólidos no grasos= sólidos totales –grasa
Sólidos grasos. (Método Gerber)
1. Colocar en el butirómetro en orden:
· 10 ml de acido sulfúrico.
· 11 ml de leche.
· 1 ml de alcohol amílico.
2. Cerrar el butirómetro con tapón de caucho.
3. Mezclar el contenido del butirómetro 180°
4. Colocar en BM con el tapón de caucho hacia abajo 15 min.
5. Retirar butirómetro del BM y centrifugar 5 min. A 1200 rpm
6. Volver a colocar el butirómetro en BM 5 min. 65°C. hasta separación de grasa.
7. Realizar lectura.
Prueba de alcohol.
1. Colocar 2 ml de leche en tubo de ensayo.
2. Adicionar 2 ml de alcohol.
3. Mezclar.
4. Observar coágulos finos. (positivo)
Adulterantes.
Almidón.
1. Colocar 10 ml de leche en tubo de ensaye.
2. Calentar a ebullición.
3. Enfriar en BH.
4. Agregar 2 gotas sol saturada de yodo.
5. Coloración azul (positivo) almidón.
Sacarosa.
1. Agregar 15 ml de leche en de ensaye.
2. Adicionar 1 ml HCl 0.1 g resorcina
3. Agitar y calentar en BM 45°C 5 min.
4. Coloración rojiza (positiva)
Índice de refracción.
1. En un matraz colocar:
· 20 ml de leche.
· 5 ml sol. Sulfato de cobre.
· Agitar y filtrar.
· Colocar 2 gotas de filtrado en prisma refractómetro calibrado.
· Determinar índice de refracción.
Ø Características organolépticas:
· Leche pasteurizada:
Color: blanco característico
Olor: característico
Sabor: característico
· Leche ultrapasteurizada:
Color: blanco característico
Olor: característico
Sabor: característico
Ø pH
· Leche pasteurizada: 6.72
· Leche ultrapasteurizada: 6.62
Ø Índice de refracción:
Ø Ácidez:
% ácidez= v*N*0.090/M(100)
V=volumen gastado en la titulación
N= normalidad
M= masa
· Leche pasteurizada: 1.6ml*0.1N*0.090/9g(100) = 0.16
· Leche ultrapasteurizada: 1.5ml*0.1N*0.090/9g(100) = 0.15
Ø Sanitizantes residules:
Ø cloruros
· Leche pasteurizada: Negativa no hubo presencia de cloruros.
· Leche ultrapasteurizada: Negativa no hubo presencia de cloruros.
Ø Sólidos grasos:
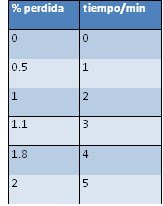
· Leche pasteurizada: 3.8%
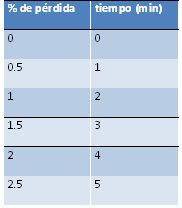
· Leche ultrapasteurizada: 0.1% (light)
Ø Lactosa:
Lactosa g/L= “f”/V*10
“f”= factor del reactive patrón de lactosa, en mg
V= ml de filtrado de la disolución defecada de la muestra.
Densidad de la leche: 1.032g/ml
1.032g 1 ml
X 11.5ml
X=11.868g
Convirtiendo g en mg:
11.868g *1000= 11868mg
f= 11868 mg
· Leche pasteurizada:
11868mg/18.6ml *10 = 6380.645mg/ml = 6.380g/L
· Leche ultrapasteurizada:
11868mg/25ml*10= 4747.2 mg/ml = 4.747 g/L